
|
О НАНОМЕХАНИКЕ ТЕМНОЙ И СВЕТЛОЙ МАТЕРИИ
Михаил Яковлевич Иванов, д.ф.-м.н
"Нашей души родовые зачатки
во много раз меньше
Нежели те, из которых слагаются тело с утробой".
Тит Лукреций Кар "О природе вещей".
В предыдущих статьях (журнал "Двигатель" № 6, 2007 г. и № 1, 2008 г.) под общим заголовком "О единой природе темной и светлой материи" была наглядно продемонстрирована возможность объяснения загадочного феномена Темной Материи (ТМ) в рамках классической механики Ньютона, моделей Ломоносова, кинетических подходов Максвелла и Больцмана. С единых позиций рассмотрена природа частиц ТМ, их основные свойства и смоделирована структура элементарных частиц обычной "светлой" материи (СМ), в частности, электрона, протона и нейтрона, в том числе их кваркового состава. Дополнительно в цитированных публикациях представлено описание электронных оболочек атомов и проиллюстрировано строение простейших атомов водорода и гелия.
 В
настоящей статье в рамках классической механики делается следующий шаг
по моделированию природы темной и светлой (неорганической и органической)
материи. Рассмотрено явление поляризации ТМ и ее фазовые состояния.
Наглядно демонстрируется исходная структура простых молекул СМ, позволяющая
природе реализовывать спиралевидную форму сложных молекул (в том числе
молекул органических соединений). Показаны примеры моделирования различных
валентных связей (ковалентной, водородной, ионной связи) и полярности
молекул с помощью детерминированного (механического) метода стационарных
электронов. Результаты моделирования и оценка дипольного момента молекул
полностью согласуются с экспериментальными данными. Метод стационарных
электронов оказывается также весьма эффективным при изучении свойств
аллотропных форм углерода (фуллеренов, углеродных нанотрубок и т.п.).
В
настоящей статье в рамках классической механики делается следующий шаг
по моделированию природы темной и светлой (неорганической и органической)
материи. Рассмотрено явление поляризации ТМ и ее фазовые состояния.
Наглядно демонстрируется исходная структура простых молекул СМ, позволяющая
природе реализовывать спиралевидную форму сложных молекул (в том числе
молекул органических соединений). Показаны примеры моделирования различных
валентных связей (ковалентной, водородной, ионной связи) и полярности
молекул с помощью детерминированного (механического) метода стационарных
электронов. Результаты моделирования и оценка дипольного момента молекул
полностью согласуются с экспериментальными данными. Метод стационарных
электронов оказывается также весьма эффективным при изучении свойств
аллотропных форм углерода (фуллеренов, углеродных нанотрубок и т.п.).
На основе изложенного материала в заключительной части статьи показана возможность моделирования на основе ТМ процесса записи и хранения генетически передаваемой наследственной информации и приобретаемой в процессе жизни информации. Здесь в качестве "флэш-памяти" выступают, в частности, сложные молекулы дезоксирибонуклеиновой кислоты (ДНК) и рибонуклеиновой кислоты (РНК), а формирование битов и байтов информации происходит с помощью частиц ТМ.
Температура - параметр состояния любой материи
 Следуя
классической феноменологической термодинамике, вводим абсолютную температуру
как параметр состояния материи (темной и светлой), характеризующий энергию
скрытого движения частиц этой материи. Для идеальной газообразной среды
элементарная кинетическая теория позволяет записать выражение осредненной
кинетической энергии частицы в виде Е= mc2=1,5kТ=0,5 mv2, где m - масса
частицы газообразной среды, T - температура, v - средняя скорость хаотического
движения частиц. Величину с можно рассматривать как скорость распространения
слабых возмущений в данной газообразной среде.
Следуя
классической феноменологической термодинамике, вводим абсолютную температуру
как параметр состояния материи (темной и светлой), характеризующий энергию
скрытого движения частиц этой материи. Для идеальной газообразной среды
элементарная кинетическая теория позволяет записать выражение осредненной
кинетической энергии частицы в виде Е= mc2=1,5kТ=0,5 mv2, где m - масса
частицы газообразной среды, T - температура, v - средняя скорость хаотического
движения частиц. Величину с можно рассматривать как скорость распространения
слабых возмущений в данной газообразной среде.
Отождествляя ТМ с классическим эфиром, при температуре T = 2,735 К вычисляем
массу частицы ТМ m = 6,5·10-40 кг и определяем ее характерные особенности
(структуру в виде диполя с элементарным зарядом порядка 10-28 Кл и т.д.).
Здесь мы фактически целиком возвращаемся к подходам Ломоносова к описанию тепловых явлений и к классической термодинамике Клаузиуса, в частности, к положению о том, что "теплота представляет собой движение мельчайших частиц вещества и эфира". Внутреннюю энергию е вещества при этом удобно, следуя Максвеллу, разделить на свободную F и связанную TS энергию e = F + TS.
Гельмгольц указал, что свободная энергия F в тепловом процессе может быть превращена в механическую работу, а связанная энергия ТS не может. Свободная энергия характеризует энергию барионной составляющей вещества, а связанная энергия - энергию другой составляющей (эфира). Рост энтропии (без внешнего подвода тепла) есть количественная характеристика "рассеяния механической энергии", т.е. той части энергии, которая в рассматриваемом процессе необратимо переходит в тепло и увеличивает величину связанной составляющей энергии.
Распределение в пространстве ТМ
 К
настоящему времени достаточно обоснованно показано, что нелюминесцирующая
ТМ составляет около 96 % общего количества вещества в нашей Метагалактике
(видимой Вселенной). 70 % всей материи достаточно равномерно распределено
по внегалактическому пространству Метагалактики, где гравитационным
взаимодействием в первом приближении можно пренебречь. Считается, что
эта часть ТМ является горячей, движущейся с релятивистскими скоростями.
Ее в настоящее время отождествляют с Темной Энергией (ТЭ) вакуума или
с особым сверхлегким ("фантомным") полем - Квинтэссенцией.
В силу соотношения для кинетической энергии ТЭ естественнее считать
суммарной кинетической энергией хаотического движения частиц ТМ во внегалактическом
пространстве Метагалактики. Оставшаяся часть ТМ (около 26 % всей материи
Метагалактики) образует шарообразные атмосферы около галактик и их скоплений
(гало галактик). Эти гало существуют благодаря действию на ТМ гравитационных
сил (аналогично существованию атмосферы Земли). Данная часть ТМ считается
холодной (или реальной ТМ в отличие от ТЭ вакуума).
К
настоящему времени достаточно обоснованно показано, что нелюминесцирующая
ТМ составляет около 96 % общего количества вещества в нашей Метагалактике
(видимой Вселенной). 70 % всей материи достаточно равномерно распределено
по внегалактическому пространству Метагалактики, где гравитационным
взаимодействием в первом приближении можно пренебречь. Считается, что
эта часть ТМ является горячей, движущейся с релятивистскими скоростями.
Ее в настоящее время отождествляют с Темной Энергией (ТЭ) вакуума или
с особым сверхлегким ("фантомным") полем - Квинтэссенцией.
В силу соотношения для кинетической энергии ТЭ естественнее считать
суммарной кинетической энергией хаотического движения частиц ТМ во внегалактическом
пространстве Метагалактики. Оставшаяся часть ТМ (около 26 % всей материи
Метагалактики) образует шарообразные атмосферы около галактик и их скоплений
(гало галактик). Эти гало существуют благодаря действию на ТМ гравитационных
сил (аналогично существованию атмосферы Земли). Данная часть ТМ считается
холодной (или реальной ТМ в отличие от ТЭ вакуума).
Нами вся ТМ рассматривается с единых позиций - как газообразная суббарионная среда, подчиняющаяся законам классической физики. Это классический газообразный эфир, скорость распространения слабых возмущений в котором с пропорциональна квадратному корню из T.
Опишем теперь более детально оставшиеся 4 % материи Метагалактики. При этом мы будем опираться на изложенные ранее модели элементарных частиц и атомов.
Поляризация и фазовые состояния ТМ
Наличие в природе ТМ с частицами, которые моделируются электрическими диполями, позволяет рассматривать явление поляризации вакуума с позиций дополнительной коллективной поляризации этих диполей под действием внешнего электрического поля. В частности, зарегистрированное экспериментально поляризованное пространство около электрона ("облако" или "шуба" электрона) благодаря присутствию ТМ может теперь быть представлено как реальное пространство, состоящее из связанных с заряженным центром электрона поляризованных частиц ТМ (а не как это предлагается в настоящее время: в виде комбинации из виртуальных электронов и позитронов).
В достаточно сильном электрическом (кулоновском) поле в зависимости от концентрации и температуры ТМ возможна реализация двух фазовых состояний поляризованной ТМ: газообразного и жидкого агрегатных состояний. При малой концентрации и высоких температурах имеем поляризованное пространство из диполей ТМ в газообразном состоянии, при высокой концентрации и низких температурах имеем поляризованное пространство в жидком фазовом состоянии. С помощью методов классической механики жидкости и газа несложно сделать оценку соответствующей кинетической и потенциальной энергии поляризованных диполей ТМ и предсказать параметры (концентрацию и температуру) фазового перехода из жидкого в газообразное состояние в поле известных кулоновских сил.
Образование электронов (в том числе электрон-позитронной пары) с поляризованным пространством в газообразном состоянии происходит при достаточно малых концентрациях (и соответствующих температурах) ТМ. Образование протонов с двухслойным поляризованным пространством (жидким и газообразным) возможно при достаточно высоких концентрациях ТМ. Главным выводом, важным для дальнейшего изложения, является возможность устойчивой локализации в стационарном состоянии электронов на внешних границах поляризованных пространств у положительно заряженных ядер протонов и атомов. Таким образом, мы имеем четкие физические обоснования для моделирования структуры атомов и молекул с помощью метода СТационарных ЭЛектронов (СТЭЛ), располагающихся на границах поляризованных пространств.
Реально существующие поляризованные пространства у атомов с формой, близкой к сферической, представляют собой известные ван-дер-ваальсовы сферы атомов, наличие которых достоверно подтверждено методами кристаллохимии и в последние годы сканирующей зондовой микроскопии. С помощью иглы туннельного микроскопа удается манипулировать отдельными шарообразными атомами, перемещать их по поверхности, строить объемные фигуры. Представление внешней границы атомов в виде ван-дер-ваальсовых сфер является в настоящее время широко распространенным методом при исследовании физико-химических свойств веществ и поверхностей твердых тел.
Структура атомов СМ
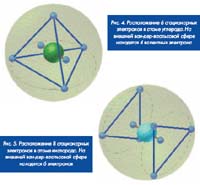
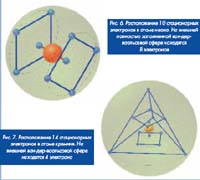
Опишем в качестве примера несколько характерных атомных структур с использованием указанной выше модели СТЭЛ. Структура атомов водорода и гелия была описана ранее, поэтому мы начнем с моделирования атома углерода С. Он содержит шесть протонов и шесть нейтронов. На первой электронной оболочке стационарно располагаются 2 электрона, на второй внешней оболочке также стационарно располагаются 4 электрона в вершинах тетраэдра (традиционного направления валентных связей. Атом кислорода О на внешней оболочке содержит 6 электронов. Наименьшая суммарная потенциальная энергия этих электронов обеспечивается при их расположении в вершинах треугольной антипризмы.
Атом инертного газа неона Ne имеет на второй внешней полностью заполненной оболочке 8 электронов, расположенных в вершинах квадратной антипризмы. Аналогичное этим атомам строение имеют атомы кремния Si, серы S и аргона Ag с тем же расположением 4, 6 и 8 электронов на третьей внешней оболочке. Несложно подобным же способом воспроизвести стационарное расположение электронов на полностью заполненной третьей оболочке с 18 электронами элементов 4-го периода (5 ряда) и четвертой оболочке с 32 электронами элементов 6-го периода таблицы Менделеева (в частности, продемонстрировать ван-дер-ваальсову сферу атома золота).
Проиллюстрированное применение модели
СТЭЛ для описания атомных структур в некоторых своих чертах повторяет
известные октеты Дж. Льюиса. Важной новизной модели СТЭЛ является расположение
электронов в вершинах антипризм, что обеспечивает минимальное значение
суммарной потенциальной энергии внешних электронов и следует из соответствующих
решений уравнения для электрического потенциала (D2 ![]() ).
).
Структура простых молекул
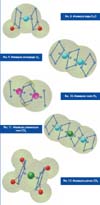
Модель СТЭЛ позволяет с единых позиций через кулоновское взаимодействие описать любые имеющиеся молекулярные связи как стационарные детерминированные структуры оболочковых электронов и ядер. Простейшая молекула водорода H2 была показана в предыдущих работах. Для геометрического представления и физического описания молекулярных связей химических элементов второго и третьего периодов таблицы Менделеева возвращаемся к модифицируемым кубическим структурам Дж. Льюиса и его октетам электронов. Здесь только вместо правильных кубов, в вершинах которых располагаются электроны, имеем квадратные антипризмы. Начнем с молекулы воды H2O. В ее несимметричной молекуле каждый атом водорода соединен ковалентной связью (парой обобществленных электронов) с атомом кислорода в соседствующих вершинах квадратной антипризмы.
В молекуле кислорода O2 атомы соединены двойной ковалентной связью. Имеем здесь на вторых орбитальных оболочках каждого атома октеты электронов, расположенных в вершинах антипризм. В молекуле азота N2 атомы соединены тройной ковалентной связью.
Геометрические модели
со структурой квадратных антипризм (с октетами электронов) и ковалентными
связями характерны для углеродистых соединений. В качестве примеров
приведем "закрученную" молекулу диоксида углерода CO2
с двойными ковалентными связями и молекулу простейшего предельного углеводорода
- метана CH4 с обычными ковалентными связями.
Соединения аналогичного углероду элемента третьего периода кремния Si
с четырьмя валентными электронами на следующей третьей электронной оболочке
также удобно представлять в форме геометрических моделей с квадратными
антипризмами с той лишь разницей, что в ковалентных связях участвуют
электроны третьей внешней электронной оболочки кремния. Пример такой
молекулы с двойными ковалентными связями представляет молекула диоксида
кремния SiO2.
(Окончание в следующем номере)
[Напоминаем, что
Интернет-вариант статьи сильно сокращен. Ред.]